酵素の巧みな反応機構を利用したタンパク質性カプセルの開発 ―バイオ×工学の材料開発―(バイオメディカル研究センター/応用化学生物学科 教授 小池あゆみ)
バイオテクノロジーは生物の機能を活用して新しい製品やプロセスを開発する分野です。バイオメディカル研究センターでは、生物がもつシャペロニンというタンパク質を、ナノサイズのカプセルとして医療分野や工学分野に応用する研究をしています。
『日本顕微鏡学会第39回論文賞(応用研究生物部門)授賞』
バイオメディカル研究センター/応用化学生物学科 教授 小池あゆみ
研究のポイント
シャペロニンは、一定時間で開閉を繰り返すナノカプセル型構造をしたタンパク質です。これまで、シャペロニンの生体内での詳細な反応機構について研究をしてきました。その知識を使い、シャペロニンの反応を制御することで、直径約5 nmの人工的な金属ナノ粒子をシャペロニンの2つの空洞に順番に閉じ込めることに成功しました。凝集性の高い金属ナノ粒子が水溶液中で安定に分散し、また、数nmの近い距離に配置することが可能となりました。この技術は、バイオセンサー、人工光合成、ドラッグデリバリーに応用が可能です。
背景
大腸菌が持つシャペロニンGroEL/GroESは、熱ストレス下の細胞内で過剰に発現します。シャペロニン自身は熱にも強く、大腸菌の細胞質に存在する約2500種の可溶性タンパク質のうち15%もの重要なタンパク質の構造形成(フォールディング)を助けるタンパク質です。GroELは、サブユニット7つからなるリングが背中合わせに2つ重なった構造をしており、それぞれのリング内部には直径約5 nmの空洞があります。ATP加水分解(※1)を伴う構造変化によってGroESを蓋のように結合し、GroEL/GroES複合体の中に変性しているタンパク質を閉じ込めて、凝集を防ぎながら構造形成させることが細胞内での本来の役割です。
研究内容・成果
この研究では、GroEL/GroES複合体が変性タンパク質の代わりに直径2〜5 nmの金属粒子を95%の効率で内包できることをTEM/STEM-EDS解析(※2)という手法を使って示しました。GroEL/GroES/金属ナノ粒子複合体は、"空の"GroEL/GroES複合体と同様に平均粒子径24 nmを示し、金属ナノ粒子の凝集を妨ぎながら水溶液中に完全に分散させることが動的光散乱計測(※3)でわかりました。さらに私たちは、ADP·BeFxという化合物を使ってGroEL/GroES複合体を形成させると2つのリングの片方にGroESが結合し、ATP·BeFxを使うと両方のリングにGroESが結合した複合体ができるという知見を利用し、2種の異なる金属粒子を段階的に2つの空洞に制御して閉じ込めることに成功しました(図1)。
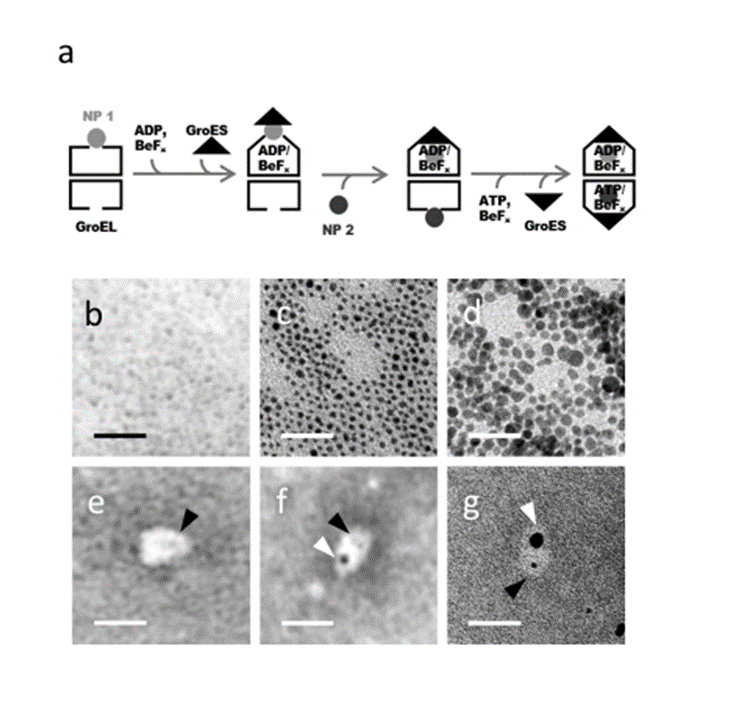
図1 金属ナノ粒子を内包したシャペロニンGroEL/GroES複合体
(a)GroEL/GroES複合体への金属ナノ粒子封入の反応スキーム
(b-g) Pt NPs (b), Au NPs (c), FePt NPs (d), Pt NP/GroEL/GroES/ADP-BeFx(弾丸型GroEL/GroES複合体で、Ptを内包している)(e), Pt NP/EL/ES/ADP-BeFx_FePt/ES/ATP(フットボール型のGroEL/GroES複合体で、PtとFePt NPを内包している)(f)、Au NP/EL/ES/ADP-BeFx_FePt/ES/ATP(フットボール型のGroEL/GroES複合体で、AuとFePt NPを内包している)(g)のTEM観察像。黒矢印は最初にカプセル化されたNPを、白矢印はGroEL/GroES複合体中に2番目にカプセル化されたNPを示す。スケールバーはすべて20 nm。NPs:ナノ粒子、TEM:透過型電子顕微鏡、ATP:アデノシン三リン酸、ADP:アデノシン二リン酸。
今後の展開
生物がもつシャペロニンの反応機構を制御し、2つの空洞に自在に異なる金属ナノ粒子を封入できることが示されました。金属ナノ粒子はがん治療や人工光合成などへの応用が可能であることから、医療や持続可能なエネルギー源の開発が期待できます。また、この技術は金属ナノ粒子だけでなく薬物(化合物)の内包にも適用できることから、ドラッグデリバリーシステムにも応用できます。
※1 ATP加水分解:アデノシン三リン酸(ATP)は全ての生物の細胞内に存在している物質。私たち人間含め全ての生物は、ATPをアデノシン二リン酸(ADP)とリン酸に加水分解することで生まれるエネルギーによって活動している。
※2 TEM/STEM-EDS解析:電子顕微鏡で見た微小な分子の中に含まれている元素(原子)の種類を特定する技術。
※3 動的光散乱計測:光を使って微小な粒子や分子がどのように振る舞うかを調べる方法。














































